|
Foto: Berlin Heart AG - Diese Axialpumpe ist das Kernstück eines neuartigen Kunstherzens, das in Berlin entwickelt wurde.
Hearts made in Berlin
Künstliche Blutpumpen überbrücken die Wartezeit bis zur Transplantation
Prof. Dr. med. Roland Hetzer, Dr. h.c. Norbert Franz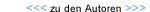
Es hat nur die Größe einer Faust, aber im Laufe eines 70-jährigen Lebens pumpt es eine Flüssigkeitsmenge, die einen Supertanker randvoll füllen würde. Das Herz ist eines der leistungsfähigsten Organe des Menschen, aber es ist auch sehr verletzlich: Herz- und Kreislauferkrankungen sind die häufigste Todesursache in Deutschland. Wenn das Herz zu versagen droht, hilft nur noch die Transplantation. Doch Spenderherzen sind rar. Um die oft lange Wartezeit zu überbrücken, werden die schwachen Herzen der Patienten durch mechanische Herzunterstützungssysteme entlastet. Nur wenige deutsche Kliniken implantieren künstliche Herzen. Dazu zählt auch das Deutsche Herzzentrum Berlin (DHZB). Prof. Dr. med. Roland Hetzer, Ärztlicher Direktor des DHZB, und Dr. h.c. Norbert Franz vom DHZB beschreiben in ihrem nachfolgenden Beitrag die technische Entwicklung von Kunstherzen und deren Einsatz seit den ersten Laborversuchen im 19. Jahrhundert bis in unsere Gegenwart. Das erste deutsche Kunstherz wurde 1977 von Prof. Dr. med. Emil Sebastian Bücherl am Klinikum Charlottenburg der Freien Universität Berlin konstruiert.
Anfänge zwischen Triumph und Tragik
Am 4. April 1969 ersetzte der amerikanische Herzchirurg Denton Cooley das versagende Herz des 47 Jahre alten Schriftsetzers Haskell Karp durch eine Plastikpumpe. Cooley hoffte, seinen Patienten am Leben zu halten, bis ein rettendes Spenderherz gefunden werden konnte. Karp lebte 60 Stunden mit dem mechanischen Herzersatz, bis dieser durch ein Spenderherz ausgetauscht werden konnte. Am Tage nach der Transplantation des Spenderherzens starb Karp – das Kunstherz hatte das Blut zwar gepumpt, dabei aber zu sehr zerstört.
Denton Cooley hatte mit der Implantation des Kunstherzens ein System angewendet, über das in vielerlei Ausführungen schon seit der Mitte des 19. Jahrhunderts nachgedacht worden war. „Wenn es gelänge, das Herz durch einen Mechanismus zur Injektion von Blut zu ersetzen, ließe sich leicht jeder Körperteil beliebig lang am Leben erhalten”, schreibt 1812 der französische Arzt Julien-Jean Le Gallois. Vladimir Demikhov hatte 1937 in Moskau die Herzen dreier Hunde durch mechanische Blutpumpen ersetzt, 1957 wiederholte er das Experiment bei weiteren fünf Hunden. Er konnte die Tiere bis zu sieben Stunden am Leben erhalten.
Eine Vielzahl von Arbeitsgruppen befasste sich weltweit verstärkt in der zweiten Hälfte dieses Jahrhunderts mit dem Problem der mechanischen Herzunterstützung. Die Entwicklung der Herz-Lungen-Maschine vor allem durch John H. Gibbon und ihr erster erfolgreicher Einsatz am 6. Mai 1953 weckte die Hoffnung, mittels der Fortentwicklung der Herz-Lungen-Maschine auch eine längerfristige Kreislaufunterstützung durchführen zu können. Clarence Dennis schloss am 1. November 1954 eine 54 Jahre alte Patientin mit schwerst rheumatisch geschädigtem Herzen an die Herz-Lungen-Maschine an in der Hoffnung, ihren Zustand stabilisieren zu können. Es gelang ihm immerhin, die Patientin für 10 Tage am Leben zu halten. Insgesamt erwies sich jedoch die Herz-Lungen-Maschine, die ja entwickelt worden war, um während einer Operation die Funktion sowohl des Herzens als auch der Lunge zu übernehmen, als ungeeignet für eine längerfristige Kreislaufunterstützung.
Mit der ersten erfolgreichen Herztransplantation durch Christiaan Barnard im Groote- Schuur-Krankenhaus in Kapstadt am 3. Dezember 1967 rückte die Herztransplantation als mögliche Behandlungsmethode des endgültig versagenden Herzens in das Licht der Öffentlichkeit. Nachdem insbesondere durch die Arbeiten der Gruppe um Norman Shumway von der Stanford University die Langzeitergebnisse der Herztransplantation verbessert werden konnten, trat der nun offensichtlich größte Nachteil dieses Verfahrens zutage: die Abhängigkeit von einem Spenderherzen, dessen Verfügbarkeit sich jeder Planung entzieht. Dem Patienten, dessen Herz endgültig zu versagen drohte, konnte zwar eine Rettung durch die Transplantation geschehen, viele der Patienten überlebten jedoch die Wartezeit nicht.
In doppelter Weise lenkte dieser Mangel Aufmerksamkeit, Aktivität und Hoffnungen auf das Kunstherz, dessen Anwendungsgebiet nun auch gefunden schien. Erfolgreiches „Bridging” – Überbrückung der versagenden Herzfunktion bis zu einer Transplantation – war nun das erste Ziel der Ärzte und ihrer Arbeitsgruppen, die auch Werkstoffkundler, Ingenieure und Techniker umfassten. Das Ziel auch des permanenten Ersatzes des menschlichen Herzens durch eine implantierbare zweikammrige Blutpumpe, durch ein „Kunstherz” also, bestand dabei bei vielen Arbeitsgruppen weiter. Michael DeBakey und Denton Cooley in Houston, Adrian Kantrowitz in Brooklyn, Walton Lillehei in Minnesota und später in Cornell, Robert Jarvik und andere forschten mit verschiedensten Pumpen und Antrieben dafür, allen voran schon seit den 50er Jahren Willem Kolff, der Erfinder der Dialysemaschine. Denton Cooley implantierte dem Patienten Willebrordus Meuffels am 23. Juli 1981 das von seinen Mitarbeitern entwickelte Kunstherz zum erfolgreichen „Bridging” beim Menschen. Triumph und Tragik waren dicht beieinander – am achten Tage nach der erfolgreichen Transplantation starb Meuffels an den Strapazen der Operationen.
Prof. Bücherl:
Ein Pionier der Kunstherz-Forschung
Auch Berlin entwickelte sich zu einem Zentrum der Kunstherz-Entwicklung. Hier war es Prof. Emil Sebastian Bücherl, der im Klinikum Charlottenburg der Freien Universität Berlin das einzige Forschungszentrum Deutschlands einrichtete, das sich mit der Entwicklung eines implantierbaren Kunstherzens befasst. Großen Widerhall in der deutschen Öffentlichkeit fanden Bilder, die er 1977 der Presse übergab. Sie zeigen das Kälbchen Leonardo, das am 97. Tag nach seiner Kunstherzimplantation vor ein Wägelchen gespannt ist, auf dem sich der Antrieb des Kunstherzens befindet. Mit der Emeritierung von Bücherl und der Gründung des Deutschen Herzzentrums Berlin setzt die Arbeitsgruppe ihre Tätigkeit am Deutschen Herzzentrum Berlin fort. Hier implantiert Roland Hetzer, Ärztlicher Direktor des Deutschen Herzzentrums Berlin, am 20. 7. 1987 einem 53-jährigen Patienten, dessen Herzfunktion während des Wartens auf eine Transplantation so schlecht geworden ist, dass die Funktion der anderen Organe durch die nicht mehr ausreichende Blutversorgung schwer gestört ist, das von der Arbeitsgruppe Bücherl entwickelte Kunstherz, nachdem er das schwer geschädigte eigene Herz des Patienten entfernt hat. Der Zustand des Patienten stabilisiert sich unter dem Einfluss des Kunstherzens rasch, und ein von Eurotransplant vermitteltes Spenderherz beendet den Kunstherz-Einsatz nach 30 Stunden. Auch diese erneute Operation übersteht der Patient gut. Tragik und Triumph sind auch hier nahe beieinander: Am Abend vor der geplanten Entlassung, gut fünf Wochen nach der ersten Operation stirbt der Patient an einer Lungenembolie.
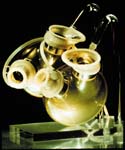
Das von der Arbeitsgruppe Bücherl entwickelte Kunstherz.
Konzeptionswechsel:
Vom reinen Herzersatz zur Herzunterstützungspumpe
Die Deutsche Forschungsgemeinschaft hatte früh das große Potential erkannt, das sich in der Kunstherz-Entwicklung befindet, und fördert und unterstützt die Kunstherz-Aktivitäten nun im Deutschen Herzzentrum Berlin weiter. Die Entwicklung des Berliner Kunstherzens nimmt nun einen anderen Weg. Aus eigenen Erfahrungen und den Erfahrungen der anderen Zentren entschließt sich Hetzer, das Herz, das bald den Namen Berlin Heart tragen wird, vom voll implantierbaren mechanischen Kunstherz in einen kleineren implantierbaren Teil umzuwandeln. Das Berlin Heart besteht aus dicklumigen, blutführenden Kanülen, die mit dem außerhalb des Körpers liegenden Teil, der Blutpumpe, verbunden sind. Das eigentliche Kunstherz wandelt sich dabei vom reinen Herzersatz zu einer Herzunterstützungspumpe, einem „AssistSystem”. Für den Zweck der Überbrückung der mangelnden Herzleistung bis zur Transplantation bietet das Assist-System einige Vorteile gegenüber dem reinen, implantablen Herzersatz. Die Implantation ist technisch einfacher, das Operationsgebiet wird für die geplante Transplantation geschont und die Funktion der transparenten Pumpen kann mit einer einfachen Taschenlampe überprüft werden. Bei Entstehen von Gerinnseln können die Pumpen einfach gewechselt werden, ohne dass dafür eine Operation mit Narkose und Eröffnung des Brustkorbes erforderlich ist. Der Druckluftgenerator des schreibmaschinengroßen Antriebs, an den die Blutpumpen angeschlossen sind, bietet doppelte Sicherheit in allen seinen Teilen. Die integrierte Batterie ermöglicht die Trennung von der Stromversorgung für eine Stunde. Den letztgenannten Vorteil nehmen die Patienten oft wahr, wenn sich nach der Implantation, die nur bei lebensbedrohlichem Herzversagen durchgeführt wird, ihr Zustand durch die Pumpen soweit stabilisiert hat, dass sie mit dem fahr- oder tragbaren Antrieb in den Krankenhauspark oder das Restaurant gehen können.
Die Fortentwicklung des Berliner Kunstherzens: das Berlin Heart.
Durch die Förderung der Deutschen Forschungsgemeinschaft konnte sich die Arbeitsgruppe „Kunstherz” des Deutschen Herzzentrums Berlin kontinuierlich der mannigfachen Probleme dieses Verfahrens widmen. Die umfassenden Kenntnisse ermöglichten der Gruppe sogar, sich später mit einer Spezialausführung der mechanischen Blutpumpe zu befassen. Es handelt sich dabei um Blutpumpen für Kinder bis hin zum Säugling und Neugeborenen. Ende der 80er Jahre hätte wohl kaum ein Industrieunternehmen die Initiative zur Entwicklung von Kunstherzen für Kinder ergriffen: Zu hoch waren die Entwicklungskosten, zu gering die Aussichten auf kommerziellen Erfolg, denn an Kunstherzen für Kinder besteht im Vergleich zu vielen anderen medizintechnischen Geräten ein zahlenmäßig eher geringer Bedarf.
Nicht immer ist bei Patienten, deren Herz zu versagen droht, das gesamte Herz betroffen. Die linke Hälfte des Herzens ist die, die die größere Pumparbeit zu leisten hat, da sie das Blut durch den großen Kreislauf treiben muss. In manchen Fällen ist es ausreichend, die Funktion dieser einen, in der Regel der linken, Herzkammer zu unterstützen. Dafür stehen heute implantierbare Assist- oder Unterstützungssysteme zur Verfügung, die aufgrund ihrer kompakten Bauweise wichtige Vorteile bieten: Die Infektionsrisiken werden geringer gehalten, weil nur die Leitung für die Energieversorgung aus dem Körper austritt. Vor allem aber ist der Patient mit diesen Systemen mobiler und netzunabhängig. Ein Batteriewechsel ist nur drei- bis viermal täglich nötig und wird vom Patienten, der auch das System in der Nacht mit dem Stromnetz verbindet, selbst durchgeführt. Hier scheint bereits ein kleiner Schritt mehr in Richtung auf den permanenten Herzersatz getan. Für Euphorie gibt es jedoch keinen Anlass, denn die Standzeiten der mechanisch besonders beanspruchten Teile der Pumpe – vor allem der künstlichen Herzklappen – sind von einem permanenten Einsatz über viele Jahre noch weit entfernt. Tatsächlich beträgt der längste Einsatz einer solchen implantierbaren mechanischen Blutpumpe in unserem Hause 794 Tage bis zur Transplantation. Erfreulich sind die Betriebssicherheit und die Bedienbarkeit, die es zunächst ermöglichen, geeignete Patienten z.B. für ein Wochenende zu beurlauben. In der Folge konnten Patienten mit implantierten Blutpumpen entlassen werden, von denen einige sogar dauerhaft ihre Berufstätigkeit wieder aufnahmen. Einer unserer jungen Patienten bereitet sich auf seine Abiturprüfung vor.
Das NOVACOR-System im Körper.
Problem Blutgerinnung:
Risiko minimiert, aber noch nicht gebannt
Neben den beschriebenen pulsatilen Systemen, d.h. neben Systemen, in denen die rhythmische Pumpbewegung des Herzens durch eine Zangenbewegung oder die Bewegung einer Membran imitiert wird, gewinnen in letzter Zeit auch Pumpen mit nicht pulsatiler, d.h. gleichförmiger Arbeitsweise an Bedeutung. Es handelt sich dabei um kleine Turbinen, die mit hoher Drehzahl bei kleinen Maßen große Fördermengen von Blut ermöglichen. Neue Werkstoffe machten diese Entwicklungen möglich. Ein Beispiel dafür ist das DeBakey-Kunstherz, eine implantierbare mechanische Axialpumpe, die De Bakey mit Hilfe der NASA entwickelte. Diese Pumpe wurde im Beisein von De Bakey weltweit erstmals im Deutschen Herzzentrum implantiert.
Eines der grundlegenden Probleme des mechanischen Herzersatzes ist die natürliche Fähigkeit des Blutes, zu gerinnen. So z. B. beim Kontakt mit allen künstlichen Oberflächen. Wird aber das Blut durch eine künstliche Pumpe bewegt, so ist die entstehende Blutgerinnung an den Kontaktflächen der Pumpe höchst gefährlich und würde unbeeinflusst zum Tode des Pumpenträgers führen. Im Laufe der Entwicklung der mechanischen Blutpumpen gelang es zusätzlich zur Behandlung mit gerinnungshemmenden Medikamenten, dieses Problem auf mehrere Arten zu entschärfen. Man beschichtete Oberflächen, die Kontakt mit Blut haben, mit Stoffen, die langsam gerinnungshemmende Substanzen (z.B. Heparin) abgeben, oder war bemüht, hydrophobe, d.h. wasserabweisende Beschichtungen aufzubringen, die eine Benetzung mit Blut überhaupt verhindern sollten, so wie z.B. eine besonders beschichtete Pfanne ein Anbacken des Kochgutes verhindern kann. Es wurden metallische körnige Beschichtungen entwickelt, die die Eigenschaft haben, sich mit einer Schicht aus Körperzellen zu überdecken, sodass die Oberflächen nicht mehr gerinnungaktivierend wirken können. Trotz all dieser Errungenschaften bleibt das Risiko der Entstehung von Gerinnseln stets ein dem Kunstherz-Einsatz innewohnendes Risiko.
Überraschender Behandlungserfolg:
NOVACOR macht schwache Herzen wieder stark
Im September 1994 wird ein 38-jähriger Heizungsbauer mit medikamentös nicht zu beeinflussendem Herzversagen notfallmäßig in das Deutsche Herzzentrum Berlin verlegt. Dem Patienten, der ein zunehmendes Lungenödem und Multiorganversagen entwickelte, wird eine implantierbare mechanische Blutpumpe von Typ NOVACOR implantiert und an das Herz angeschlossen. Er stabilisiert sich nach der Operation schnell und wartet auf ein Herz zur Transplantation. Es fällt den behandelnden Ärzten auf, dass in den folgenden Monaten die Funktion des erkrankten Herzens besser zu werden scheint. Trotz der engmaschigen und genauen Überwachung seiner Blutgerinnung, die während der gesamten Implantationsdauer durch Medikamente beeinflusst werden muß, zeigt sich plötzlich eine vorübergehende Schädigung der Hirnfunktion, die vermutlich von kleinsten Gerinnseln herrühren, die aus der Blutpumpe über den Kreislauf in das Hirn gelangen und dort glücklicherweise nur vorübergehende Schäden bewirken. Die Entscheidung, dem gut stabilisierten Patienten die in diesem Falle gefährlich werdende Herzpumpe zu entfernen, fällt trotz der festgestellten Besserung der eigenen Herzfunktion nicht leicht. Gemeinsam mit dem Patienten einigt man sich darauf, keine neue Unterstützungpumpe zu implantieren. Am 8. März 1996 wird nach einem Einsatz von fünfeinhalb Monaten die Pumpe wieder aus dem Körper entfernt. Der Patient erwacht schnell aus der Narkose und kann am nächsten Tag trotz aller Vorbereitung kaum glauben, was ihm erklärt wird. Die versagende Funktion des eigenen Herzens, die bei seiner Aufnahme ein Weiterleben ohne Kunstherz unmöglich gemacht hatte, hat sich unter der Unterstützung durch die mechanische Blutpumpe erholt. Erst ungläubig, dann glücklich verbringt der Heizungsbauer noch einige Tage im Krankenhaus und ist seitdem bis auf den heutigen Tag in guter Verfassung. Er konnte sicher nicht ahnen, welche Forschungsaktivität die überraschende Verbesserung seines Zustandes im Deutschen Herzzentrum Berlin bewirkte.
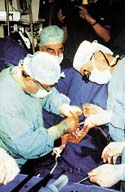
Implantation eines Kunstherzens im DHBZ.
Die besondere Erkrankung, die bei unserem Patienten zum Herzversagen geführt hatte, ist in ihrem Mechanismus noch wenig erforscht. Sie geht mit der Bildung von Antikörpern im eigenen Körper, die während der zerstörenden Phase der Erkrankung stets anwesend und messbar sind, einher. Der Krankheitsverlauf des Heizungsbauers hatte bewiesen, dass die Entlastung des Herzens durch ein Kunstherz über längere Zeit eine Erholung bewirkt hatte, und auch die Antikörper waren verschwunden. Diese Erkenntnis stand am Anfang einer Serie von heute 28 Patienten, die bei gleicher Erkrankung im lebensbedrohlichen Zustand mit der Unterstützungspumpe versehen worden waren, längere Zeit mit diesem System unterstützt wurden und allesamt wieder von der Pumpe befreit werden konnten, da sich das eigene Herz erholt hatte. Glücklich und ein wenig stolz präsentierten die ersten sechs dieser Patienten dem Fotografen Schilder, auf denen die Dauer ihrer mechanischen Kreislaufunterstützung bis zur Explantation der Pumpe vermerkt ist. Bei etwas mehr als der Hälfte der so behandelten Patienten erwies sich die Erholung bisher als jahrelang dauerhaft.

Zwischen 160 und 795 Tagen hatten diese sechs Männer mit Kunstherzen gelebt, weil ihre eigenen Herzen versagten. Und dann die überraschende Wendung: Die eigenen Herzen hatten sich so gut erholt, dass auf die Unterstützung durch die Kunstherzen verzichtet werden konnte. Bei der Hälfte der Patienten erwies sich die Erholung als dauerhaft.
Das Phänomen der Erholung dieser Patienten gab auch den Ansatz zur Entwicklung einer völlig neuen Behandlungsweise. War die Erholung dieser Patienten verbunden mit dem Verschwinden des Antikörpers, so wollte man versuchen, die Bildung von Antikörpern direkt zu verhindern. Mit einem geeigneten Verfahren, der Immunadsorption, gelang die erhoffte günstige Beeinflussung bei vielen Patienten mit dieser Erkrankung. Die im Deutschen Herzzentrum Berlin erfolgreich praktizierte Kombination von Kunstherz-Einsatz und Immunadsorption ist auf dem besten Weg, sich in der „nichtischämischen dilatativen Kardiomyopathie” weltweit als neue Behandlungsmethode durchzusetzen.
Auch diese erfreulichen Erfolge dürfen nicht darüber hinweg täuschen, dass wir heute das Ziel, ein auf Dauer tragbares Kreislaufunterstützungssytem zu schaffen, noch nicht ganz erreicht haben. Die darin von vielen erhoffte Alternative zur Herztransplantation bietet derzeit noch keines der gegenwärtig vorhandenen Systeme in vollem Umfang. Die Verbesserungen der bestehenden Systeme lassen darauf schließen, dass in wenigen Jahren tatsächlich ein oder mehrere Systeme vorhanden sein werden, die die Hoffnungen der Pioniere dieses Verfahrens erfüllen werden. Der erstmalige Einsatz des „Lion Hearts”, einer voll implantierbaren Unterstützungspumpe, wie sie für mehrere der bestehenden Systeme entwickelt wird, gelang erfolgreich im Jahr 1999. Das Besondere dieser Pumpe, die auch im Berliner Herzzentrum zur Verfügung steht, ist ihre kontaktlose Stromversorgung: Ein unter die Haut implantierter Akkumulator wird durch Induktion aufgeladen. Die Energiezufuhr erfolgt im Prinzip genauso wie bei handelsüblichen elektrischen Zahnbürsten, und es bestehen keine Infektionspforten durch Kabel oder Schläuche.
Vollimplantierbare Systeme aus Berlin stehen vor klinischer Erprobung
Die Bilanz des gegenwärtigen Standes der Kunstherz-Entwicklung ist insgesamt erfreulich. Daran haben Berliner Akivitäten wesentlichen Anteil. Vielversprechende Perspektiven für die zukünftige Kunstherz-Entwicklung in Berlin eröffneten sich 1996 mit der Gründung der „Berlin Heart AG”, eines medizintechnischen Unternehmens, das auf den Erfahrungen des Deutschen Herzzentrums Berlin aufbaut und mit ihm eng zusammenarbeitet. Hier begann nun die Entwicklung von zwei neuen, vollimplantierbaren Herzunterstützungssystemen. Eine neue pulsatile Pumpe, Berlin Heart Incor pulse genannt, wird aufgrund der verringerten Größe und des verringerten Gewichts zukünftig auch für kleine und schmale Patienten anwendbar sein. Im Vergleich zu bestehenden Systemen setzt es neue Maßstäbe, denn bislang sind die am Markt verfügbaren pulsatilen Systeme nur bei Patienten von großer Körperstatur einsetzbar. Erstmalig soll es gelingen, eine Redundanz-Funktion durch zwei unabhängige Antriebseinheiten zu integrieren. Ein zweites implantierbares System ist in der Entwicklung: Die Axialpumpe Berlin Heart Incor axial wird ähnlich wie das DeBakey-Kunstherz mit einer kleinen Turbine angetrieben. Aufgrund einer neuen magnetischen Lagerung ist sie verschleißfrei und arbeitet mit einem minimierten Risiko der Thrombenbildung. Eine noch kompaktere Bauweise vereinfacht die Implantation. Die verbesserte Regelung des Systems ermöglicht eine pulsierende Unterstützung des Kreislaufs. Die klinische Erprobung beider Kunstherzen ist für das Jahr 2001 geplant.
Jedoch ist nicht nur der technische Teil der Entwicklung von Kunstherzen oder Assist-Systemen von Bedeutung. Der Patient, der den Mittelpunkt unseres Interesses darstellt, braucht mehr als die technische Hilfe einer mechanischen Unterstützung. Mit dieser muß stets die psychische Betreuung des Patienten verbunden sein, der derzeit in Abhängigkeit von einem technischen Gerät auf eine Herztransplantation wartet, und notfalls die seiner Angehörigen. Diese Betreuung wird im Deutschen Herzzentrum Berlin von einem Team von Ärzten der Psychosomatik und Psychologen geleistet und ist untrennbar mit dem Kunstherz-Einsatz verbunden.
|
Information
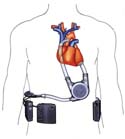 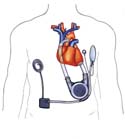
Berlin Heart Incor pulse – das Kunstherz der Zukunft
Berlin Heart Incor pulse heißt das von der Berliner Firma Mediport Kardiotechnik GmbH entwickelte Kunstherz, dessen klinische Erprobung im Jahr 2001 beginnen wird. Dieses Kunstherz gibt es als teil- und als vollimplantierbare Varianten. Bei der teilimplantierten Variante (links) wird nur die Pumpe mit ihrem Antrieb in den Körper eingesetzt. Kontrollsystem und Energieversorgung werden außerhalb des Körpers am Gürtel getragen und sind mit der implantierten Pumpe verbunden. Bei der vollimplantierten Variante (rechts) sind alle Komponenten wie Kontrolleinheit, aufladbare Batterie und Ausgleichskammer implantiert. Es gibt keine Verbindung mehr von innen durch die Haut hindurch. Die Energie zum Betrieb des Kunstherzens wird durch die geschlossene Hautoberfläche per Induktion über eine Spule übertragen. Das neue magnetische Antriebssystem gestattet es, die Größe des implantierbaren Systems um ein Drittel im Vergleich zu herkömmlichen Systemen zu reduzieren. Dadurch wird es auch für kleine und schmale Patienten anwendbar sein.
|

|